来源: CMDE作者: 小创整理

创新医疗器械特别审查申请审查结果公示(2021年第12号)
依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告)要求,创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行了审查,拟同意以下申请项目进入特别审查程序,现予以公示。
1.产品名称:螺旋导流集成式膜式氧合器
申 请 人:东莞科威医疗器械有限公司
2.产品名称:经导管三尖瓣瓣环成形系统
申 请 人:上海汇禾医疗科技有限公司
3.产品名称:静脉支架系统
申 请 人:上海蓝脉医疗科技有限公司
4.产品名称:胸腹主动脉覆膜支架系统
申 请 人:先健科技(深圳)有限公司
5.产品名称:肠息肉消化内镜辅助诊断软件
申 请 人:长沙慧维智能医疗科技有限公司
6.产品名称:肾小球滤过率动态监测系统
申 请 人:MediBeacon,Inc.
7.产品名称:血管内超声诊断系统(IVUS)
申 请 人:深圳北芯生命科技有限公司
8.产品名称:胶原基软骨修复基质
申 请 人:四川拜阿蒙生物活性材料有限责任公司
9.产品名称:膝关节置换手术辅助系统
申 请 人:骨圣元化机器人(深圳)有限公司
10.产品名称:锆铌合金股骨头
申 请 人:苏州微创关节医疗科技有限公司
11.产品名称:一次性血管内超声消融导管和超声消融仪
申 请 人:乐普(北京)医疗器械股份有限公司
公示时间:2021年10月25日至2021年11月8日
公示期内,任何单位和个人有异议的,可以书面、电话、邮件等方式向我中心综合业务部反映。
联 系 人:张欣
电话:010-86452928
电子邮箱:gcdivision@cmde.org.cn
地址:北京市海淀区气象路50号院1号楼
特别说明:进入创新审查程序不代表已认定产品具备可获准注册的安全有效性,申请人仍需按照有关要求开展研发及提出注册申请,药品监督管理部门及相关技术机构将按照早期介入、专人负责、科学审查的原则,在标准不降低、程序不减少的前提下进行审评审批。
国家药品监督管理局
医疗器械技术审评中心
2021年10月25日
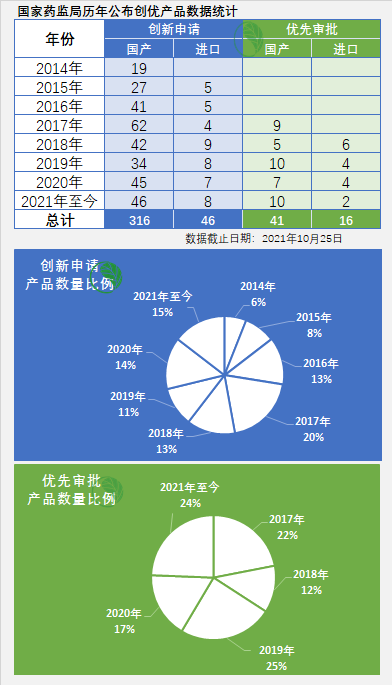
历年统计
声明:此文版权归原作者所有,若有来源错误或者侵犯您的合法权益,您可通过邮箱与我们取得联系,我们将及时进行处理。