来源: 医疗器械创新网2023年03月08日
根据Sedgwick 的一份报告,美国食品和药物管理局召回的 I 类医疗器械数量在 2022 年创下 15 年来的新高。2022 年,FDA 监督了 70 次 I 级召回,这是其最高风险分类,而过去五年平均为 47 次。18 次一级召回发生在第四节。在过去五个季度中的三个季度中,贴错标签是最常见的召回原因。
去年,包括雅培、百特、GE 医疗、美敦力和飞利浦在内的公司成为 I 类召回的对象,FDA 将这一类别保留给可能造成严重伤害或死亡的问题。该活动加起来创下了 I 类召回记录。Sedgwick 在统计了第四季度的数据后报告了 15 年的 I 级召回新高。今年最后三个月,各类召回总数环比增长 8.1%,召回数量增加约 1000 万台至 6198 万台。
贴错标签再次成为第四季度最常见的召回原因,过去五个季度中的三个季度都是如此,其次是质量问题。与软件相关的召回数量有所下降,这是第三季度最常见的召回原因。在上一时期的 46 起事件中,软件在今年最后三个月中造成了 15 起召回事件。
报告称,根据 1 月份的数据,到 2023 年,第三季度和第四季度之间召回的增加可能会继续。Sedgwick 在 1 月份统计了 135 次召回,而第四季度的月平均召回次数为 80 次。召回数量也高于第四季度的水平。
Sedgwick 确定了 FDA 使用第 518 节的权限,该权限允许它命令制造商通知患者和提供者风险,这是医疗设备召回中最重要的发展之一。FDA 表示,一年前使用该权力命令飞利浦将其呼吸设备召回告知患者,因为该公司在这一点上的努力“不够充分”。
从2022年境外召回产品产地分布情况来看,有107款产品产自美国,数量最多,其次德国有7款产品,英国和日本均有6款产品位居第三。
2022年境外召回产品产地分布
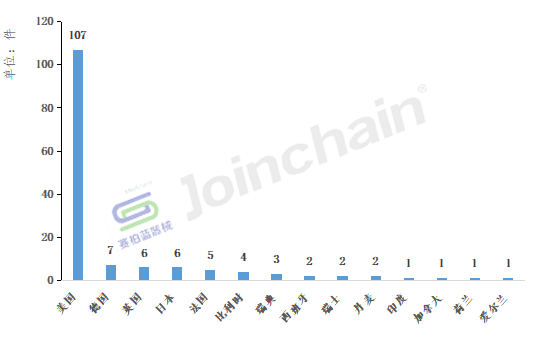
数据来源:赛柏蓝器械、众成数科
按产品类别划分,全年境外召回事件共涉及104种产品,其中核磁共振成像系统被召回的数量最多,共有23款。
2022年境外召回产品类别分析
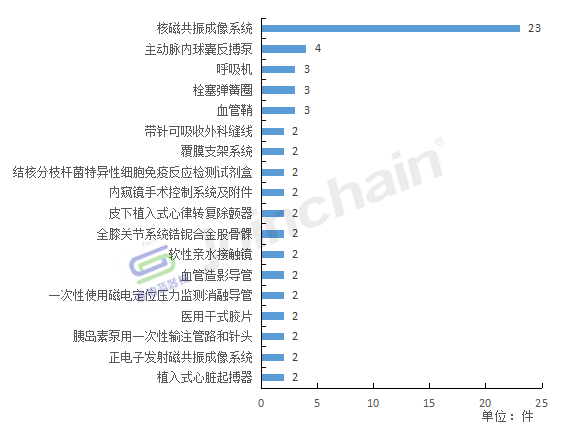
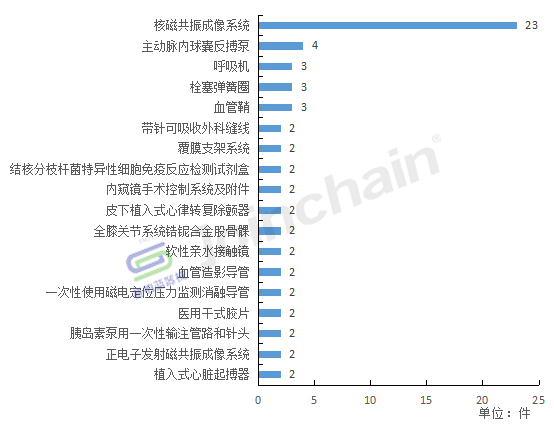
数据来源:赛柏蓝器械、众成数科
丨雅培:2022年I级召回一次事件
2022年5月,雅培召回 Dragonfly OpStar成像导管,用于可能导致患者伤害的潜在松动导管标记带。FDA 已将此确定为 I 类召回,这是最严重的召回类型。使用这些设备可能会导致严重伤害或死亡。
召回产品:蜻蜓 OpStar 显像导管,在美国召回的设备数量:4,800台。
丨百特:2022年I级召回了5次
2022年11月,FDA对Baxter(百特)公司的WatchCare失禁管理系统(IMS)进行了最严重的 I 级召回通知。值得注意的是,此次因故被召回的产品均来自Hillrom,该公司正是去年年末百特斥巨资收购的业务。
理由是因为WatchCare设备的射频可能会干扰其他医疗设备,包括患者和工作人员身上的设备。FDA的召回通知还指出,其他第三方医疗设备也可能受到影响,这种射频干扰可能导致这些其他设备的错误读数或其他故障,并因此导致不适当的医疗干预,从而造成严重伤害或死亡。这也是为何此次召回被定义为 I 级的原因。
此外,22年6月,百特呼吸机也面临同样情况被 FDA 标记为 I 类召回事件,在美国召回259 个 Volara 患者回路套件以及9 个其他 Volara 装置。无独有偶,受影响的产品也来自于这家百特新收购的 Hillrom 医疗器械企业。
Baxter在6月初披露,使用在线适配器的患者可能无法获得足够的氧气 。该公司注意到一份关于在家庭护理环境中将 Volara 与呼吸机配合使用时氧饱和度降低的报告。几周后,FDA 的通知提到了一项投诉、一名受伤和两人死亡。
2022年3月,百特Baxter召回带有主药物库(第 8 版)的 SIGMA Spectrum 输液泵和带有 Dose IQ 安全软件(第9版)的Spectrum IQ输液系统,因为存在不会对重复的上游阻塞事件发出警报的风险。FDA 已将此确定为 I 类召回。
丨GE医疗:2022年一次I级召回事件
2022年6月,GE CARESCAPE 呼吸机的 被FDA通告I 类召回!此次召回包括用于 Carescape R860 的 29,417 个备用电池,以及用于Carescape R860、Engström Carestation和Engström PRO的88,347个备用备用电池。
召回原因:由于电池可能无法提供足够的备用电源,因此呼吸机在未连接到交流主电源时可能会过早关闭。比预期更早耗尽的电池可能会关闭呼吸机并停止向患者供应氧气,从而危及生命。本次呼吸机电池召回事件涉及超过100000台。目前公司发言人表示召回只涉及故障电池,暂不需要取回其他设备部分。FDA已将本次召回归类为 I 类事件。
丨美敦力:2022年期间出现7次I级召回事件
2022年9月,美敦力召回 NIM CONTACT 增强型 EMG 气管插管和 NIM 标准增强型 EMG 气管插管,存在气道阻塞风险。FDA 已将此确定为 I 类召回,这是最严重的召回类型。使用这些设备可能会导致严重伤害或死亡。在美国召回的设备:53,029 台,在美国以外召回的设备:339,260 台。
2022年7月,FDA发布消息称,将美敦力正在召回的100多万根透析导管界定为一级召回。据悉,美敦力此次召回始于6月8日,产品涉及美敦力旗下子公司柯惠医疗(Covidien)生产的九种不同的透析导管产品。
针对此次事件,美敦力回应称:“目前没有关于患者受到伤害的报告,产品检索正在进行中。此事根本原因正在调查中,美敦力已通知所有适用的监管机构。”
2022年6月,由于有缺陷的焊接与至少一名患者死亡有关,美敦力正在召回相关的 1614 件HeartWare 心室辅助设备(HVAD)系统产品。早在一年前,美敦力就因为I级召回而宣布停止分销和销售其 HVAD系统。虽然美敦力最初在 4 月底向患者和医疗保健提供者宣布了紧急医疗设备纠正措施,但安全问题已升级为全面召回,本次再次获得 FDA 最严重的 I 级召回。作为FDA 最严重的召回类型,目前该产品已累计收到15次I级召回。
2022年第二季度,美敦力进行了两次大规模召回,涉及产品分别是Harmony 输送导管系统和HVAD 泵植入套件。
其中Harmony 输送导管系统在放置 TPV 的过程中,输送导管末端的胶囊可能会断裂。该故障引起了6起投诉,1起受伤。
除此之外,2022年3月,美敦力还一级召回686定向斑块切除系统,存在尖端损坏风险,美敦力正在召回(更正)该产品,因为它与最近被召回进行更正的另一台设备共享设计相似性。在使用过程中施加力时,导管内的导丝有向下移动或脱垂的风险。
丨飞利浦:2022年5次I级召回事件
2022年6月3日,FDA发布通知表示,飞利浦伟康召回了所有V60和V60 Plus呼吸机,因为电源问题可能导致呼吸机在有或没有警报的情况下停止。FDA已将此次召回确定为 I级召回。
2022年12月21日,飞利浦(NYSE:PHG)对其被召回的DreamStation睡眠治疗设备进行了健康风险测试。测试表明,被召回设备的某些排放物“不太可能对病人的健康造成明显的伤害”。
2022年11月22日,FDA宣布飞利浦呼吸机召回事件再升级,新增91例死亡和超2万例MDR(2022年8月1日至2022年10月31日),累计共收到了超过9万份关于飞利浦呼吸设备召回的故障报告和260份死亡报告。
在医疗器械领域,“召回”只是一种对不良产品解决途径的方式,排除安全隐患能让召回发挥出应有的价值。所以医疗企业为了保障更多患者的安全,更应当更加严守“安全防线”,真正将产品安全与产品创新做到一起前行。
免责声明
本文来源为其他媒体的内容转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们